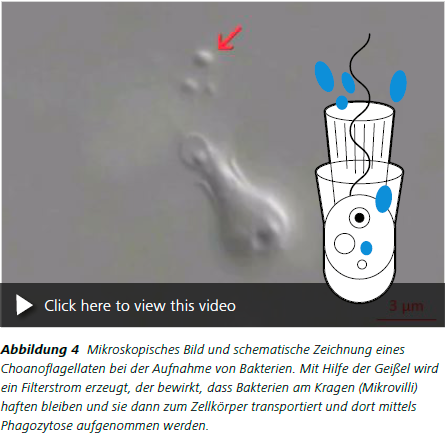
Einleitung
Die Güte von Gewässern ist ein Thema, das in nahezu jedem gesellschaftlichen System eine Rolle spielt. Daher werden Oberflächengewässer aller Art hinsichtlich ihrer Qualität und Nutzbarkeit untersucht. Die im Wasser lebenden Organismen sind leicht zu gewinnen und von hohem Wert als Indikator. Sie lassen durch ihre Spezialisierung auf Umgebungsbedingungen schnelle und nachhaltige Rückschlüsse zu. Die mit dem bloßen Auge nicht wahrzunehmenden Organismen lassen sich mit Routinemikroskopen schnell, preiswert und sicher erkennen und bestimmen. Der Aufbau eines derartigen Gewässermonitorings sei am Beispiel von Berliner Flusswasser dargestellt.Wissenswertes über Einzeller (Flagellaten und Ciliaten)
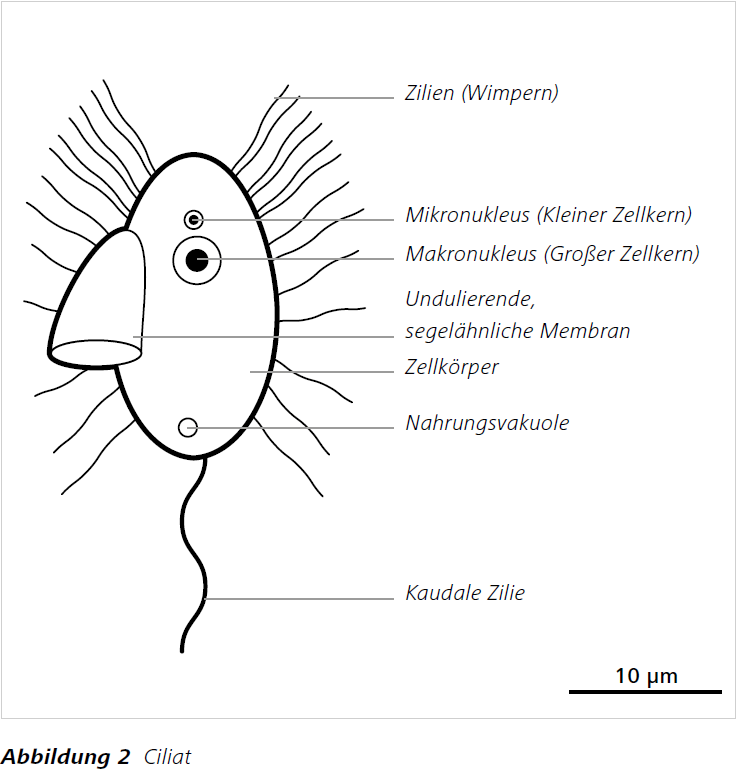
Flagellaten (Abbildung 1) sind Einzeller mit einer oder mehreren Geißeln. Ciliaten (Abbildung 2) sind bewimperte und meist etwas größere Einzeller. Beide gehören zur eukaryotischen Organismengruppe der Protisten. Sie besitzen einen echten Zellkern und zahlreiche Unterfunktionen. Sie treten in vielfältigen, morphologischen Ausprägungen auf. Teilweise entdeckt man Hunderte von ihnen innerhalb eines einzigen Wassertropfens. Seit einigen Jahrzehnten ist bekannt, dass diese Protisten einen enormen Beitrag zur Reduktion von Bakterien innerhalb der mikrobiellen Schleife leisten können, da sie sich heterotroph von Bakterien ernähren (Grazing = „Abweiden“) (Azam et al. 1983, Arndt et al. 2000, [2]). Darüber hinaus spielen sie eine bedeutende Rolle bei der Erforschung der Entwicklung von Organismen zur Mehrzelligkeit. Man geht davon aus, dass alle heutigen Mehrzeller (Tiere) und die Protistengruppe der Choanoflagellaten (Kragengeißeltierchen) einen gemeinsamen Vorfahren haben und sich die Mehrzeller aus solchen Protisten entwickelt haben könnten (z.B. Richter und King 2013).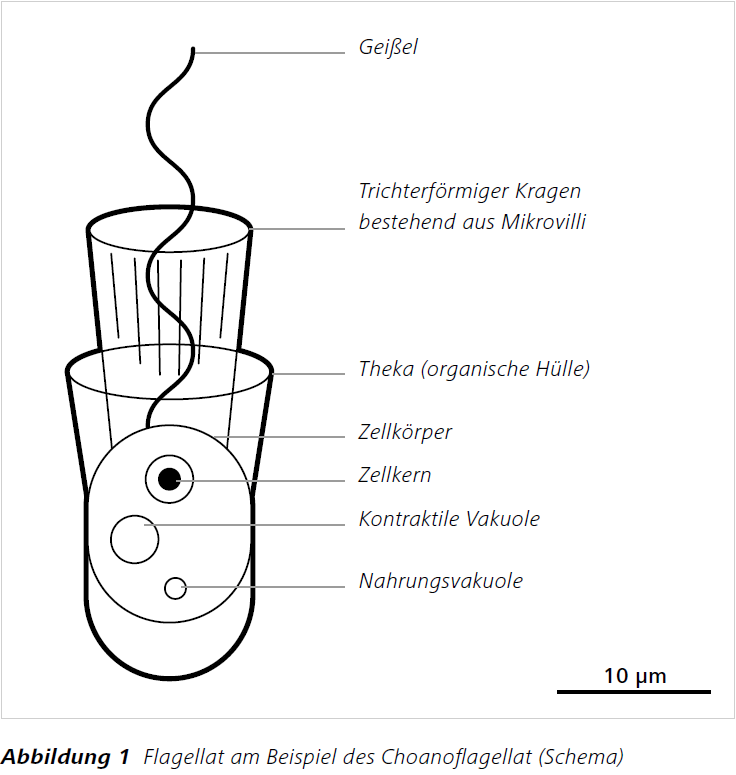
Methodik des Gewässermonitorings am Beispiel der Flusshygiene
Für die routinemäßige Gewässeruntersuchung werden neben allgemeinen abiotischen Werten wie Temperatur, Leitfähigkeit und pH-Wert biotische Parametern wie Chlorophyll-Werte – auch die Abundanz und Diversität von Protisten mit Hilfe von einfach zu bedienenden Lichtmikroskopen lebend bestimmt. Es werden vorzugsweise Mikroskope verwendet, die leicht an die jeweiligen Probenahmeorte transportiert werden können. Solche Untersuchungen erfolgen u.a. im Rahmen des „FLUSSHYGIENE“ – Verbundvorhabens (ReWaM –Regionales Wasserressourcen-Management für den nachhaltigen Gewässerschutz in Deutschland, gefördert vom Bundesministerium für Bildung und Forschung), innerhalb dessen Probenahmen bundesweit an verschiedenen Fließgewässern (Spree-Havel-System in Berlin, der Ruhr in Nordrhein-Westfalen, den Flüssen Rhein und Mosel in Rheinland-Pfalz sowie den Flüssen Isar und Ilz in Bayern) durchgeführt werden. Im Berliner Stadtgebiet (Spree-Havel-System) werden Beprobungen u.a. in Zusammenarbeit mit Wasserforschungsinstituten, den betroffenen Gesundheits- und Umweltbehörden, sowie den Wasserver- und Abwasserentsorgungsbetrieben (u.a. Kompetenzzentrum Wasser gGmbH, Landesamt für Gesundheit und Soziales, Berliner Wasserbetriebe) durchgeführt. Ziel des „FLUSSHYGIENE“-Verbundvorhabens ist es, erweiterte Erkenntnisse über Eintrag und Dynamik hygienischer Belastungen in Fließgewässern zu erlangen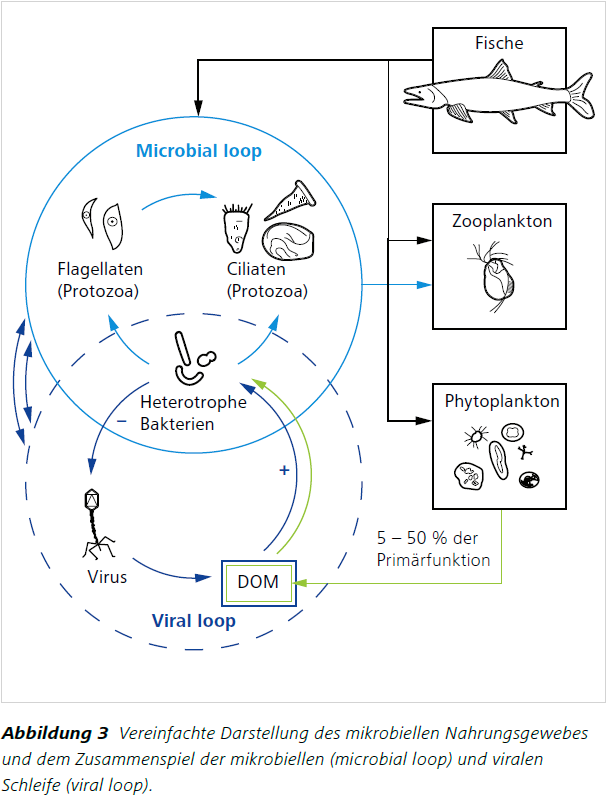
Probenahme, Präparations- und Bestimmungstechnik
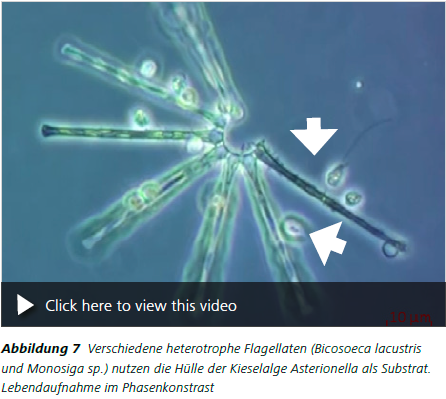
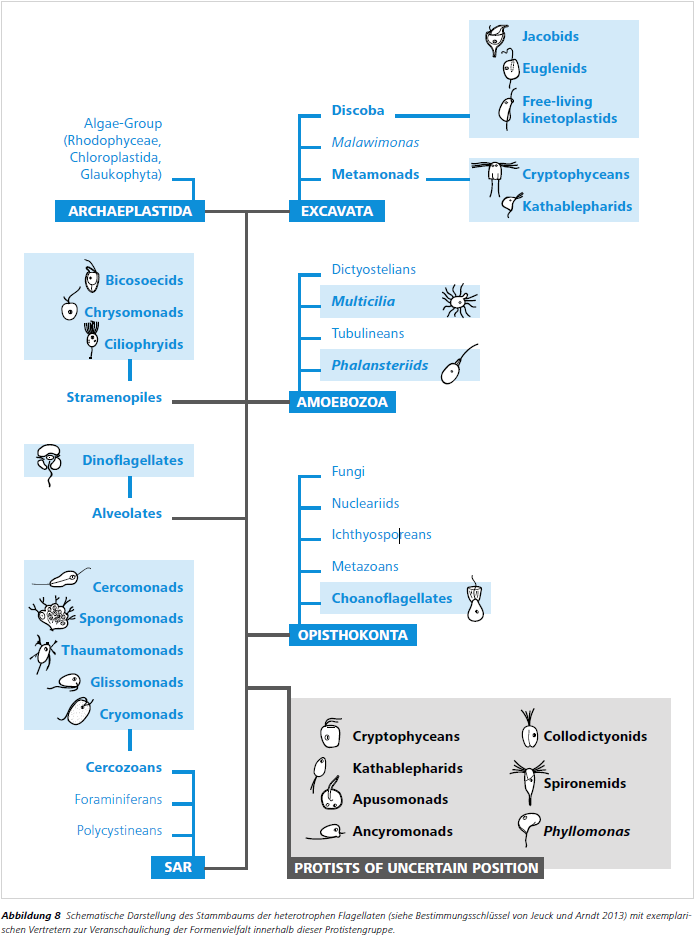
Methodisch wird bei der Lebenduntersuchung von Protisten so vorgegangen, dass an den jeweiligen Gewässern Wasserproben mit einem Ruttner-Schöpfer genommen werden (z.B. drei Replikate à 100 ml ungefiltertes Wasser für die Analyse der heterotrophen Flagellaten). Diese werden anschliessend gekühlt und lichtgeschützt bis zur mikroskopischen Lebenduntersuchung aufbewahrt. Diese Lebendanalyse sollte so schnell wie möglich innerhalb einer Stunde nach Probenahme erfolgen, um das Risiko des Absterbens sowie mögliche Interaktionen der Organismen so gering wie möglich zu halten. Zur mikroskopischen Bestimmung werden daraufhin z.B. jeweils mehrere Parallelen einer 5 – 10 μl Wasserprobe auf einen Objektträger gegeben. Zwei Deckgläser links und rechts daneben sowie ein drittes Deckglas auf dem Tropfen verhindern ein Zerdrücken der Organismen. Die heterotrophen Flagellaten werden mit 200 – 400facher Vergrößerung und unter Zuhilfenahme des Phasenkontrastes lebend untersucht (Abb. 5 bis Abb. 7). Der Phasenkontrast ist unerlässlich für die Erkennung von Geißelformbewegung und sonstigen speziellen Zellbestandteilen (Kragen, Lorica, Ejektisomen etc., Abb. 7). Bei der Bestimmung der Flagellaten wird auf spezielle Bestimmungsliteratur zurückgegriffen (z.B. Jeuck und Arndt 2013, Abb. 8).
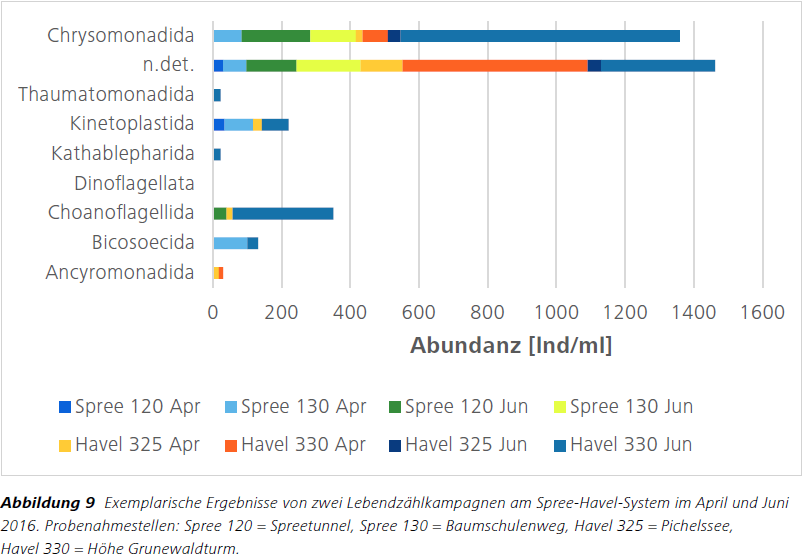
 Anschließend werden die bestimmten und gezählten Protistenzahlen auf einen Milliliter hochgerechnet, um Abundanzen und Diversität abschätzen zu können. Anhand der gefundenen Flagellatengruppen können Rückschlüsse auf die Elimination bezüglich pathogener Keime getroffen werden (Abb. 9).
Anschließend werden die bestimmten und gezählten Protistenzahlen auf einen Milliliter hochgerechnet, um Abundanzen und Diversität abschätzen zu können. Anhand der gefundenen Flagellatengruppen können Rückschlüsse auf die Elimination bezüglich pathogener Keime getroffen werden (Abb. 9).
 Manche Organismen (z.B. Kinetoplastiden) nehmen weniger Bakterien pro Zeiteinheit auf als andere (z.B. Choanoflagellaten mit ihrer starken Strudelbewegung und recht großem Kragen), vgl. Boenigk und Arndt 2000 und Abb. 8 für die äußerlichen Unterschiede). Lichtmikroskopische Gewässeruntersuchungen von lebenden Einzellern können durch Bestimmung von Abundanzen,
Biovolumina, jeweiligen Fraßtypen und unter zur Hilfenahme von abiotischen und biotischen Parametern und Bakterienabundanzen erste Näherungswerte zur Abschätzung von bakterieller Konsumption / Protisten-Grazing im jeweils untersuchten Gewässer bieten. Diese Konsumptionsraten bieten die Möglichkeit, Handlungsempfehlungen zur Förderung der gewässerinternen Eliminationsleistung für potentielle Krankheitskeime aufzustellen, die dann auch auf andere Gewässertypen übertragbar sein können.
Manche Organismen (z.B. Kinetoplastiden) nehmen weniger Bakterien pro Zeiteinheit auf als andere (z.B. Choanoflagellaten mit ihrer starken Strudelbewegung und recht großem Kragen), vgl. Boenigk und Arndt 2000 und Abb. 8 für die äußerlichen Unterschiede). Lichtmikroskopische Gewässeruntersuchungen von lebenden Einzellern können durch Bestimmung von Abundanzen,
Biovolumina, jeweiligen Fraßtypen und unter zur Hilfenahme von abiotischen und biotischen Parametern und Bakterienabundanzen erste Näherungswerte zur Abschätzung von bakterieller Konsumption / Protisten-Grazing im jeweils untersuchten Gewässer bieten. Diese Konsumptionsraten bieten die Möglichkeit, Handlungsempfehlungen zur Förderung der gewässerinternen Eliminationsleistung für potentielle Krankheitskeime aufzustellen, die dann auch auf andere Gewässertypen übertragbar sein können.
Fazit
Je mehr gelöstes organisches Material (DOM) und Bakterien sich in einem Gewässer befinden und / oder von außen z.B. durch Starkregenereignisse und dadurch bedingte überlaufende Kanalisationen in ein Gewässer eingetragen werden, desto mehr Protisten können teilweise nachgewiesen werden. Protisten ernähren sich von Bakterien, die wiederum DOM aufnehmen, also von deren Verfügbarkeit abhängen. Unter Einsatz von einfacher, routinemäßig nutzbarer Optik können diese kleinen, in ihrer ökologischen und evolutionären Bedeutung stark unterschätzen Organismen schnell bestimmt und gezählt werden. Durch die Nutzung von leicht zu bedienenden Lichtmikroskopen können wichtige Aussagen über die Güte von Gewässern getroffen und neue Erkenntnisse für potentielle Maßnahmen zu ihrer Verbesserung gewonnen werden.Empfohlene Mikroskopische Ausrüstung
Die typischen Kontrastverfahren am Mikroskop für aquatische Organismen sind Hellfeld, Phasenkontrast und Dunkelfeld. Mit ZEISS Axio Lab.A1 und einem achromatisch – aplanatischen Universalkondensor können diese leicht eingestellt werden. Die Größe der Protisten liegt zwischen 1 und 150 μm und kann daher gut mit 10×, 20× und 40× Objektiven erfasst werden. Um die Zilienmerkmale sicher bestimmen zu können, ist auf eine gute optische Korrektur (z.B. N-Achroplan Objektive) zu achten. Phasenkontrast ist essentiell in der Charakterisierung, werden doch die Zellbestandteile visualisiert. Mit dem Differentiellen Interferenzkontrast (DIC) kann man noch tiefere Einblicke in das Zellinnere gewinnen, da auch feine Zellbestandteile kontrastiert werden können.¹¹Zu Choanoflagellaten: Einzeller des Jahres 2017: http://www.protozoologie.de EinzellerdesJahres2017.html) Das einen aquatischen Organismus durchströmende Licht, erfährt zum Teil an einigen Zellbestandteilen gegenüber dem unbeeinflussten Licht eine sogenannte Phasenverschiebung der Lichtwellen. Der „Phasenkontrast“ im Mikroskop vergrößert diesen Abstand der Wellenfronten indem er das Beleuchtungs- und gebeugte Licht aus dem Präparat durch einen sogenannten Phasenring im Objektiv leitet. Kommt es im Idealfall zu einem Versatz von Lambda / 2, dem Auslöschungskriterium der Interferenz, tritt als maximaler Kontrast Schwarz auf. (Lit.) Anders beim DIC Verfahren – hier wird der Beleuchtungsstrahl durch ein Prisma unterhalb der optischen Auflösung in zwei leicht phasenverschobene Strahlen getrennt. Werden diese nach Passage der Zellorganellen wieder vereinigt, werden die feinen Phasenunterschiede der Organellen als ein virtuelles Relief Bild sichtbar. Hierfür kann z.B. ein AxioScope.A1 als Stativ eingesetzt werden. (LIT).
Literatur
[1] Arndt, H., Dietrich, D., Auer, B., Cleven, E., Gräfenhan, T., Weitere, M., Mylnikov, A. (2000) Functional Diversity of Heterotrophic Flagellates in Aquatic Ecosystems. In LeadbeaterBSC, Green JC (eds) The Flagellates. Taylor & Francis, London, 240 – 268.
[2] Azam, F., Fenchel, T., Field, J. G., Gray, J. S.,Meyer-Reil, L. A., Thingstad, F. (1983) The ecological role of water-column microbes in the sea. Marine Ecology Progress Series 10: 257 – 263.
[3] Boenigk, J., Arndt, H. (2000) Comparative studies on the feeding behavior of two heterotrophic nanoflagellates: the filter-feeding choanoflagellate Monosiga ovata and the raptorial-feeding kinetoplastid Rhynchomonas nasuta. Aquatic Microbial Ecology 22: 243 – 249.[4] Deng, L., Krauss, S., Feichtmayer, .J, Hofmann, R., Arndt, H., Griebler, C. (2014) Grazing of heterotrophic flagellates on viruses driven by feeding behaviour. Environmental Microbiology Series 6: 325 – 330.
[5] Jeuck, A., Arndt, H. (2013) A short guide to common heterotrophic flagellates of freshwater habitats based on the morphology of living organisms. Protist 164: 842 – 860.
[6] Richter, D. J., King, N. (2013) The genomic and cellular foundations of animal origins. Annual Review of Genetics 47: 509 – 537.