Einleitung
Viele Studien zeigen, dass Malaria eine der häufigsten importierten Erkrankungen bei Reisenden und Migranten ist. Man rechnet mit 25.000 Erkrankungsfällen und 250 Todesfällen jährlich in Industrieländern. Es erkranken Touristen und beruflich im Ausland tätige Personen, sehr häufig aber auch Migranten nach einem Heimaturlaub, sog. visiting friends and relatives (VFR). Mehr als 50 % der Malariafälle in Deutschland betreffen diese VFRs.- Die Malaria hat also auch in der Reisemedizin eine stetige Bedeutung:
- da sie relativ häufig importiert wird.
- da sie eine lebensbedrohliche Erkrankung ist, die aber bei frühzeitiger Diagnosestellung stets geheilt werden kann
- da sie differenzialdiagnostisch bei einer Vielzahl von Symptomen bedacht werden muß.
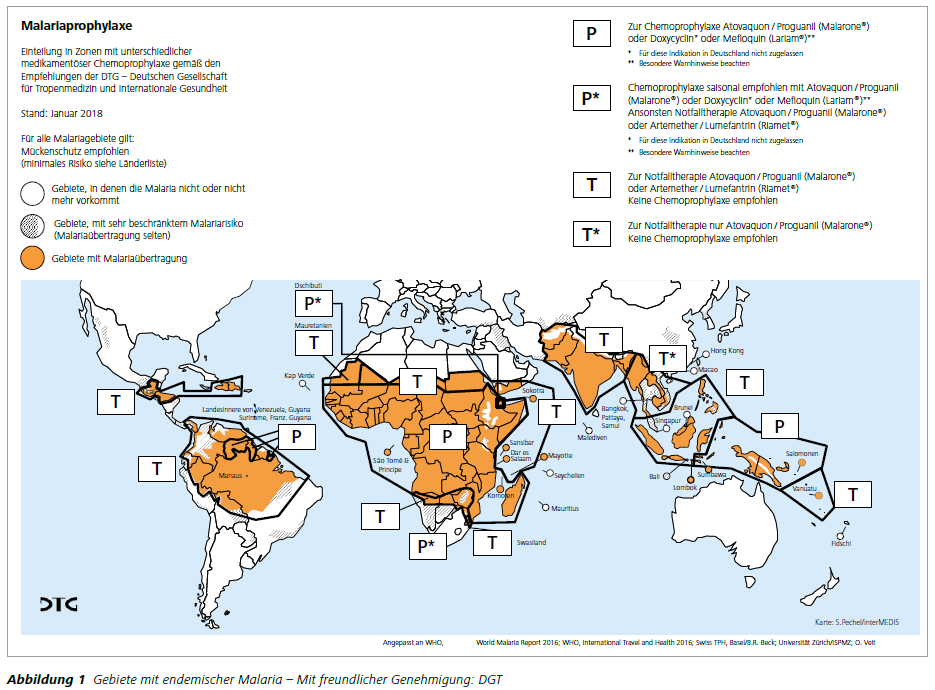
Wo kann man sich anstecken?
Malaria ist eine der am weitesten verbreiteten Infektionskrankheiten. Sie ist früher bis an den Polarkreis und südlich bis Nordargentinien aufgetreten (1922 / 1923 wütete eine Malaria- Epidemie in Archangelsk in Nordrussland). Die heutige Verbreitung ist auf die Tropen und Subtropen beschränkt. Am höchsten ist das Malariarisiko im tropischen Afrika, woher auch die meisten importierten Fälle kommen,
Ausgedehnte Malariagebiete gibt es auch in Brasilien und benachbarten Ländern Südamerikas. Selten ist die Malaria in Mittelamerika. In Haiti und den angrenzenden Gebieten der Dominikanischen Republik tritt sie in einem einzigen isolierten Gebiet in der sonst malariafreien Karibik auf. Im Vorderen Orient findet sich die Malaria nur sporadisch. Malariagebiete erstrecken sich aber von Pakistan über China bis Südostasien. In Ozeanien sind vorwiegend Papua-Neuguinea, die Salomoninseln und Vanuatu betroffen.
Was sollte man von der Parasitologie der Erreger wissen?
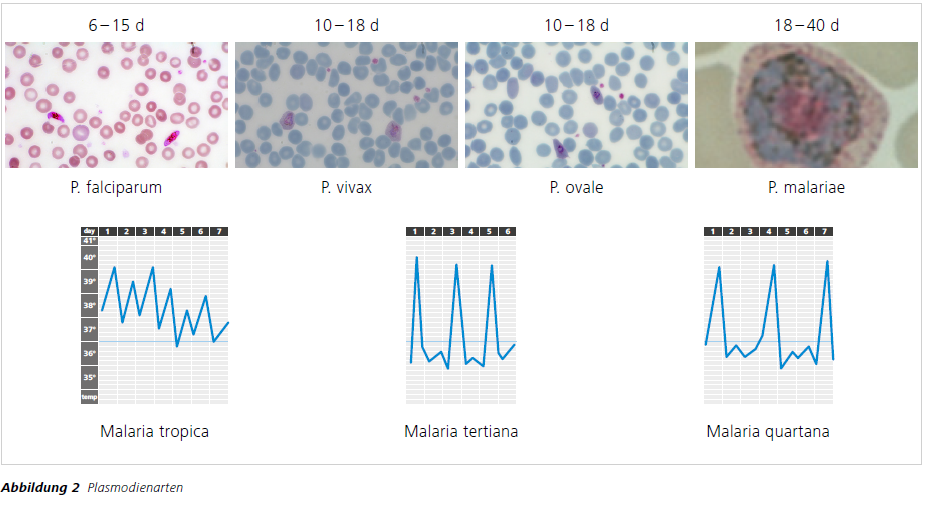
- Erreger der Malaria ist der einzellige Parasit Plasmodium. Vier Plasmodienarten infizieren den Menschen:
- Plasmodium falciparum ist der Erreger der Malaria tropica (englisch: malignant tertian malaria)
- Plasmodium vivax und Plasmodium ovale verursachen die Malaria tertiana (englisch: benign tertian malaria)
- Im Verlauf des Lebenszyklus (siehe Abb. 4 schematische Darstellung Lebenszyklus) in der Mücke und im Menschen durchlaufen die Plasmodien eine Reihe von Entwicklungsstadien, in denen sie immer wieder die äußere Gestalt verändern:
- Mit Hilfe von Geruchssinnesorganen an Antennen und Fühlern finden die Mücken den Wirt und durchbohren mit ihrem Stechapparat die Haut und Gefäßwand. Sie injizieren ein Antikoagulans und saugen etwa 1 – 3 μl Blut. Während dieser Blutmahlzeit werden von der Mücke die infektiösen Stadien der Plasmodien – die Sporozoiten – in die Blutbahn injiziert.
- Die Sporozoiten dringen innerhalb von 30 – 60 Minuten in Leberzellen ein, wo sie sich in eine große, vielkernige Zelle, den Schizonten, verwandeln. Dieser teilt sich in viele tausend kleine Zellen, die Merozoiten, die nach ein bis zwei Wochen in den Blutstrom freigesetzt werden (präerythrozytäres Stadium).

Wie führen die Plasmodien zu Krankheitserscheinungen?
Krankmachend sind die erythrozytären Formen der Plasmodien. Gewebe-Schizonten und Gametozyten spielen keine Rolle. Anämie, Ischämie, Immunreaktionen und Speicherphänomene des retikulohistiozytären Systems (RHS) sind die Hauptkomponenten der Pathogenese. Im Einzelfall sind die Organe in unterschiedlicher Häufigkeit beteiligt, dadurch wird der klinische Aspekt des jeweiligen Patienten bestimmt. Histopathologisch wurde bereits vor Jahrzehnten beschrieben, dass viele parasitierte Erythrozyten – also Erythrozyten, die Plasmodium falciparum enthalten – sich in den zerebralen Kapillaren anreichern und diese zu verstopfen scheinen (Abb).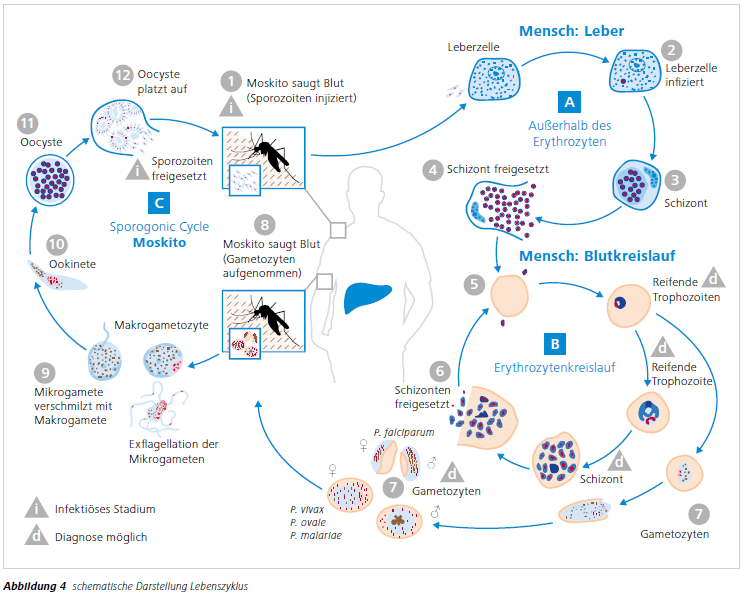
Elektronenmikroskopische Untersuchungen ergaben, dass parasitierte Erythrozyten Ausstülpungen ihrer Zellmembran, sogenannte knobs, aufweisen und dass diese knobs sich an die Endothelzellen anlagern. Auf den parasitierten Erythrozyten werden Antigene exprimiert, die an Rezeptoren auf den Endothelzellen adhärieren. Folge sind Mikrozirkulationsstörungen und Funktionsstörungen des Gefäßendothels. Zellen des Makrophagen Monozyten-Systems sezernieren darüber hinaus proinflammatorische Zytokine. Zytokine, wie das TNF, führen nun wiederum dazu, daß bestimmte Adhäsionsmoleküle auf den Gefäßwandzellen im Gehirn in erhöhter Zahl exprimiert werden – damit wird also wiederum die Adhärenz parasitierter Erythrozyten verstärkt. Mikrozirkulationsstörungen, Defekte des Gefäßendothels und Freisetzung von Zytokinen wie z.B. TNF-a sind die wesentlichen Pathomechanismen der Malaria tropica.
Gibt es eindeutige klinische Zeichen einer Malaria?
Die Präpatenzzeit (bis zum Auftreten von Trophozoiten im Blut) beträgt im Allgemeinen 7 – 21 Tage, die Inkubationszeit (bis zum Auftreten von Symptomen) meist einige Tage länger. Nach Durchführung einer nicht voll wirksamen medikamentösen Prophylaxe kann die Inkubationszeit deutlich verlängert sein. Durch Synchronisation des Parasitenzyklus können bei der Malaria tertiana die Fieberschübe alle 48 Stunden, bei der Malaria quartana alle 72 Stunden auftreten. Symptome aller Malariaformen sind plötzlich auftretendes Fieber, Schüttelfrost, Kopf- und Gliederschmerzen. Die Symptome sind vielgestaltig, die Malaria wurde deshalb auch als „a master of masquerade“ bezeichnet. Bei der Malaria tropica und bei der Knowlesi-Malaria kann die Parasitendichte rasch zunehmen, und es können sich Organkomplikationen entwickeln – insbesondere am Gehirn, an den Nieren und den Lungen. Eine zerebrale Malaria manifestiert sich meist als diffuse Enzephalopathie mit unterschiedlich tiefem Koma und kann rasch zum Tode führen. Ein akutes Nierenversagen ist eine häufige Komplikation, das Nierenversagen führt oft in Kombination mit metabolischer Azidose und Lungenödem zum Tode.
Nachweis
Voraussetzung für die Identifikation von Malaria ist das Darandenken! Aufschlussreich sind retrospektive Auswertungen zu schweren Verläufen und Todesfällen bei Reisenden: In England war der verzögerte Nachweis ein wesentlicher Risikofaktor. Eine Studie in der Schweiz ergab, dass einige Patienten mit Malaria, die vom Hausarzt ohne Diagnostik wieder nach Hause geschickt wurden, kurz darauf starben ohne erneut einen Arzt aufgesucht zu haben – das zeigt, dass die Diagnose unverzüglich gestellt werden muss.Grundlage des Nachweises ist auch heute noch der direkte Erregernachweis unter dem Lichtmikroskop.
Die Plasmodien lassen sich in einem Blutausstrich nachweisen, bei geringer Parasitendichte muss ein Dicker Tropfen als Anreicherungsverfahren herangezogen werden. Diese einfachen Techniken haben bei korrekter Durchführung eine hohe Sensitivität und Spezifität. Die Plasmodien sind anhand ihrer charakteristischen Morphologie intraerythrozytär zu erkennen. Sowohl im Dicken Tropfen als auch im Ausstrich erscheinen das Chromatin der Zellkerne rot-violett, das Plasma blau und die Erythrozyten im Ausstrich grau. Für die Bestimmung der Plasmodien-Spezies ist neben der Parasitenmorphologie auch die Morphologie der befallenen Erythrozyten von Bedeutung: Besondere Kennzeichen der Erreger der Malaria tertiana (P. vivax und P. ovale) sind eine zunehmende Vergrößerung und Abblassung der befallenen roten Blutkörperchen und eine feine rosa Punktierung (Schüffner- Tüpfelung); dagegen sind Erythrozyten, die mit P. falciparum. P. malariae oder mit P. knowlesi infiziert sind, weder vergrößert noch getüpfelt. Blutausstriche bei P. falciparum-Infektionen sind gekennzeichnet durch das Auffinden ausschließlich junger Ringformen und das Fehlen anderer asexueller Entwicklungsstadien wie Trophozoiten oder Schizonten. Im Gegensatz dazu finden sich bei allen anderen Plasmodien-Infektionen neben Ringformen auch Trophozoiten und Schizonten im Blutausstrich, Bei Vorliegen von sexuellen Stadien (Gametozyten) ist P. falciparum durch seine typische längliche, gebogene Form (Bananen-Form) von den anderen Plasmodien- Spezies leicht abgrenzbar. Die Einnahme von Antibiotika kann die Morphologie der Plasmodien beeinflussen und die Parasitämie herabsetzen.
Die Anfertigung und Beurteilung parasitologischer Blutausstriche erfordert viel Erfahrung, die oft nur bei spezialisierten Ärzten und MTAs oder in tropenmedizinischen Institutionen vorhanden ist. Wenn keine ausreichende Erfahrung vorliegt, sollte daher bei jedem Verdacht auf das Vorliegen einer Malaria umgehend Blut in einem spezialisierten Labor untersucht werden. Die sofortige Einsendung von luftgetrockneten, unfixierten, ungefärbten dicken Blutausstrichen (Dicken Tropfen) und Methanol-fixierten, ungefärbten dünnen Blutausstrichen sowie von 2 ml EDTA-Blut per Bote oder Taxi auch über größere Entfernungen kann lebensrettend sein. Das Resultat soll innerhalb weniger Stunden vorliegen. Der dicke Blutausstrich (“Dicker Tropfen”) hat den Vorteil, dass durch die fehlende Fixierung und die Lyse der roten Blutkörperchen einzelne Parasiten auch in mehreren Schichten von Erythrozyten mikroskopisch untersucht werden können. Im Vergleich zum dünnen Blutausstrich ist die Sensitivität für den Nachweis von Plasmodien im Dicken Tropfen um das etwa 10-fache erhöht. Obwohl die Beurteilung erschwert ist, gelingt es dem erfahrenen Untersucher meist schon im Dicken Tropfen die verschiedenen Plasmodienarten zu unterscheiden. In der Regel ist zumindest eine Unterscheidung zwischen P. falciparum und den anderen Plasmodien-Infektionen möglich. Zusätzliche Informationen für die Spezies-Diagnostik liefert die Mikroskopie des dünnen Ausstrichs. P. knowlesi ist mikroskopisch schwer von den anderen Plasmodien zu differenzieren. Die Nachweisgrenze der Mikroskopie liegt bei 50 Parasiten pro Mikroliter Blut, das entspricht einer Parasitämie von unter 0,001%.
Technische Durchführung
- Dünner Blutausstrich Färbung nach Giemsa-Romanowski:
- Prinzip: Intraerythrozytär gelegene Plasmodien werden durch Anfärbung sichtbar gemacht.
- Durchführung: Kapillarblut oder antikoaguliertes Venenblut (EDTA) ausstreichen und mit absolutem Methanol fixieren (mindestens 1 Minute). Nach dem Trocknen Giemsa-Gebrauchslösung für 40 Minuten auf den Objektträger geben. Giemsa-Gebrauchslösung frisch zubereiten: 1 ml Giemsa-Stammlösung + 9 ml Pufferlösung (pH 6,8 – 7,2), anschließend gründlich mit Leitungswasser spülen.
- Bewertung: Standardmethode
- Dicker Blutausstrich („Dicker Tropfen“)
- Durchführung: Einen Tropfen Kapillarblut (ca. 10 μl) oder antikoaguliertes Venenblut (EDTA) auf einen Objektträger bringen und auf ca. 1 cm2 so verrühren, dass man gerade noch durchsehen kann. Der Tropfen muss gut trocknen und darf nicht fixiert werden. Den getrockneten Dicken Tropfen mit Giemsa-Gebrauchslösung (s.o.) färben, dazu die Farblösung für 40 Minuten auf den Objektträger bringen und anschließend mit Leitungswasser vorsichtig abspülen, nach dem Trocknen kann unter Öl mikroskopiert werden.
- Bewertung: Standardmethode
- Schnellfärbeverfahren Dünner Blutausstrich:
- Prinzip: Kurze Anfärbung mit fertigen Lösungen, z.B. mit Diff Quick®.
- Durchführung: Fixation mit absolutem Methanol für eine Minute, Eintauchen in Eosin-Lösung für 10 sec, Abspülen mit Wasser, Eintauchen in Thiazin-Lösung für 30 sec, Abspülen mit Wasser.
- Bewertung: schnellste Methode, aber teurer als Giemsa- Färbung mit der Standardmethode, Plasmodien etwas schlechter angefärbt.
- Dicker Tropfen: Schnellfärbeverfahren wie z.B. Diff Quick® sind ebenfalls geeignet: Dicken Tropfen lufttrocknen lassen, Eintauchen in Eosin-Lösung für 1 min, Eintauchen in Thiazin-Lösung für 1,5 min, kurz mit Leitungswasser abspülen, trocknen lassen.
- Bewertung: schneller, aber teurer als Giemsa-Färbung mit der Standardmethode.

Empfohlene Mikroskopausstattung
Die gefärbten Parasiten werden typischerweise mit einem aufrechten Hellfeldmikroskop bestimmt und identifiziert. Spezifische Merkmale wie zum Beispiel die Schüffner-Tüpfelung können mit hochwertigen Objektiven und passendem Kondensor visualisiert werden. Typische Vergrößerungen von 10×, 20× und 40× gestatten die erste Lokalisation von Plasmodien. Zur genauen Identifikation werden hochaperturige Öl-Objektive mit Vergrößerungen von 63× oder 100× – typischerweise ohne Deckglaskorrektur (o.D.) verwendet. Wird zum Beispiel ein Objektiv ZEISS EC Plan-NEOFLUAR 63× / 1,25 Oil (#420480-9901-000) oder ein ZEISS N-ACHROPLAN 100× / 1,25 Oil o.D. (#420994) eingesetzt, sollte der passende achromatisch -aplantische Kondensor (# 424225-9070-000) verwendet werden. Zur Dokumentation empfiehlt sich eine Kamera mit guter Dynamik, präziser Bilderfassung auf Pixelebene und idealerweise einer (Peltier-) Kühlung zur Verbesserung des Signal-Rausch-Verhältnisses. Mit der Mikroskopkamera ZEISS Axiocam 305 (#426560-9030-000) und einem Kameraadapter 0,63× oder 1,0× ist dieses gewährleistet.© Carl Zeiss Microscopy GmbH