Einleitung
Haare gehören zu den biologischen Fasern, die am weitesten verbreitetet sind. Relevanz hat ihre Untersuchung unter anderem für die Aufklärung von Diebstahl, Wildunfällen im Rahmen der Versicherungsregulierung, die Untersuchung von Zollvergehen / Wilderei aber auch Kriminaldelikte wie Mord. Je nach Art, Anzahl und Zustand der Haarproben finden verschiedene Methoden der forensischen Haaranalyse ihre Anwendung.
Fragen, die geklärt werden sind: Handelt es sich tatsächlich um ein Haar oder eine Pflanzen- oder Textilfaser? Falls es ein Haar handelt, ist es ein menschliches Haar oder ein Tierhaar?
Von welcher Körperregion stammt das Haar? Ist das Haar ausgerissen, abgeschnitten, abgequetscht oder versengt?
Fragen, die geklärt werden sind: Handelt es sich tatsächlich um ein Haar oder eine Pflanzen- oder Textilfaser? Falls es ein Haar handelt, ist es ein menschliches Haar oder ein Tierhaar?
Von welcher Körperregion stammt das Haar? Ist das Haar ausgerissen, abgeschnitten, abgequetscht oder versengt?

Das Haar
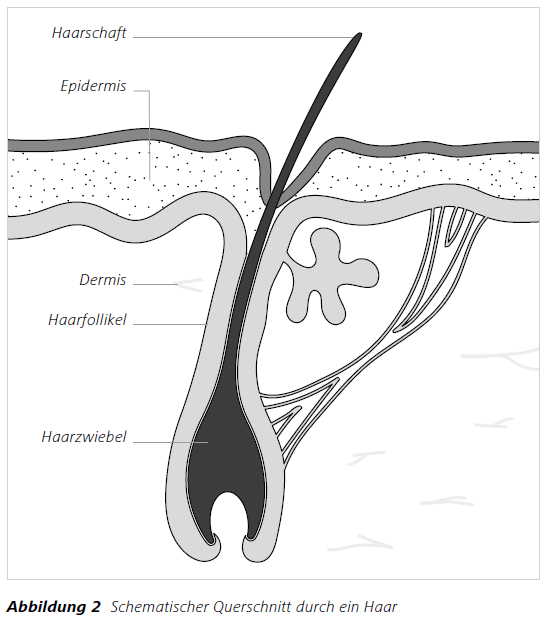
Jede Säugetierspezies besitzt Haare mit charakteristischen Merkmalen wie Länge, Farbe und Wurzelstruktur sowie spezifischen morphologischen Merkmalen (Abbildung 1). Haare (lat. pili) sind Hornfäden (Abbildung 2), die hauptsächlich aus Keratin bestehen und bei allen Säugetieren vorkommen.
Ein Haar besteht aus der Haarwurzel und dem Haarschaft. Der Haarschaft ist prinzipiell aus Mark, Rinde und Kutikula (Abbildung 1) aufgebaut.
Die Kutikula oder die äußere aus verhornten, abgestorbenen Zellen gebildete Schuppenschicht. Die Rinde (Cortex) bezeichnet den Faserstamm des Haares, welcher sich aus Faserbündeln zusammensetzt, die wiederum aus feinsten Unterfasern, den Fibrillen aufgebaut sind.
Das Mark (Medulla) bezeichnet den inneren Bereich, der auch Hohlräume bilden kann.
Ein Haar besteht aus der Haarwurzel und dem Haarschaft. Der Haarschaft ist prinzipiell aus Mark, Rinde und Kutikula (Abbildung 1) aufgebaut.
Die Kutikula oder die äußere aus verhornten, abgestorbenen Zellen gebildete Schuppenschicht. Die Rinde (Cortex) bezeichnet den Faserstamm des Haares, welcher sich aus Faserbündeln zusammensetzt, die wiederum aus feinsten Unterfasern, den Fibrillen aufgebaut sind.
Das Mark (Medulla) bezeichnet den inneren Bereich, der auch Hohlräume bilden kann.
Haare von Wildtieren unter dem Mikroskop
Unter dem Lichtmikroskop sind Haare eine umfassende Quelle für Informationen, da das Licht als Informationsträger die genannten Strukturen durchdringen kann. Jede Säugerspezies besitzt Haare mit charakteristischer Länge, Farbe und Wurzelstruktur sowie spezifischen morphologischen Merkmalen, anhand derer die Bestimmung von Art und Gattung möglich ist. Die Behaarung von Säugetieren wird in der Regel als Fell bezeichnet und in Fellhaare (Capilli, als Leit- und Grannenhaare), Borstenhaare (Setae), Wollhaare (Pili lanei) und Langhaare unterschieden. Viele Säugetiere besitzen Vibrissen (Tasthaare) [1]. Hierbei dienen die Nervenenden um die Haarwurzel (Follikel) als Sensoren.Die Haare verschiedener Körperregionen desselben Individuumskönnen dabei beträchtliche Variabilität aufweisen. Die Struktur von Mark und Kutikula der Haare ist streng tierartspezifisch. Sie erlaubt daher auch eine sichere Unterscheidung zwischen Mensch und Tier. Als Kriterien zur genauen Speziesbestimmung dienen die Struktur der Markzellen, Markdicke, der Markstrahl, die Anzahl der Markzellschichten sowie das Dickenverhältnis von Haarmark zu Haarrinde. Außerdem können Gehalt und Verteilung von Pigmenten sowie das Oberflächenprofil der Kutikulazellen analysiert werden.
Eine mikroskopische Analyse der Haarwurzel erlaubt sowohl die Bestimmung der Wachstumsphase, als auch eine Unterscheidung zwischen „ausgerissen“ und „ausgefallen“. Die klassische Mikroskopie ermöglicht folglich eine Bestimmung von Spezies, Rasse, Haartyp und Haarstatus [2]. Typ, Anzahl und Erhaltungszustand der sichergestellten Haare beeinflussen dabei erheblich ihren Wert als Spurenmaterial für die forensische Untersuchung mit dem Lichtmikroskop.
Die typischen, unfallrelevanten Tierklassen sind Bestandteil der Routineuntersuchung in den meisten Laboratorien, da zum Beispiel die Versicherungsleistung abhängig vom unfallverursachenden Tier ermittelt wird. Für die mikroskopische Betrachtung wird dabei das Haar auf einem Objektträger fixiert [3]. Typische Vergrößerungen sind 10×, 20× und 40×. In seltenen Fällen findet auch ein 100× Ölobjektiv Verwendung. Mitunter macht die Pigmentierung ein Anpräparieren der Medulla notwendig. Mit Glycerin als Einbettmedium werden gute Resultate erzielt.
Fallbeispiel: Kunstfaser oder Naturfell
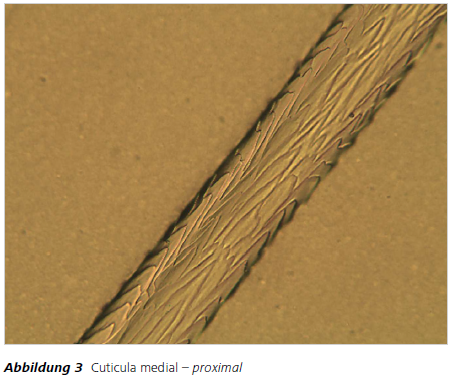
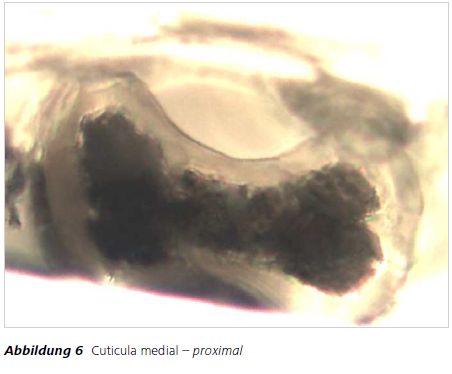
Die morphologische Haaranalyse eignet sich bis zu einem gewissen Grad zur Speziesidentifizierung. Anwendungsgebiete sind z.B. Wildunfälle, bei denen die Überprüfung auf Haarwild erforderlich sein kann. Auch die Analyse von Pelzapplikationen an Kleidungsstücken auf tierische Herkunft ist von Bedeutung; insbesondere wenn solche Applikationen als Kunstpelz deklariert werden. In solchen Fällen kann durch Ausführung eines geeigneten Untersuchungsganges Klarheit erzielt werden. Zu prüfen ist dabei zunächst, ob es sich um tierische Haare handelt. Dazu kann nach dem Abdruckverfahren auf Vorhandensein der für tierische Haare typischen Cuticulastruktur geprüft werden.Ist das Ergebnis positiv kann durch zusätzliche Analyse der Medulla und eventuell des Haarquerschnittes eine Bestimmung der Spezies oder zumindest einer Gruppe von Spezies erreicht werden. Das Ergebnis der rein mikroskopischen Untersuchung in einem Fall von Kunstpelz-Deklaration ist den Abbildungen 3 – 6 zu entnehmen. Durch Vergleich mit entsprechendem Referenzmaterial lautete das Ergebnis in diesem Fall: 1. Es handelt sich um tierische Haare und 2. Es handelt sich mit Sicherheit um Haare eines Leporiden (Hasenartige).
Es lag also klar eine Falschdeklaration vor.
Um eine definitive Speziesidentifizierung zu erzielen wurde zusätzlich ein DNA-Test durchgeführt. Dieser ergab, dass es sich um Haare eines Kaninchens (Oryctolagus cuniculus) handelte. Selbst wenn letztlich ein Test durchgeführt wird, sollte auf die lichtmikroskopische morphologische Analyse nicht verzichtet werden, da bei Versagen des DNA-Tests trotzdem eine Aussage möglich ist. Dies wäre nach Lyse und Extraktion des Haares nicht mehr möglich.


Empfohlene Mikroskopausstattung
Mit den Lichtmikroskopen ZEISS Axio Lab.A1 oder auch ZEISS Axio Scope.A1 stehen aufrechte Mikroskope dem untersuchenden Labor zur Verfügung. Da es in der Betrachtung auf die feinen Strukturen der Cuticula ankommt, sind einerseits lichtstarke, aber auch hochaperturige Optiken von Vorteil. Der Kondensor sollte ebenfalls so gewählt sein, dass er neben Hellfeld auch Dunkelfeld zulässt, z.B. der ZEISS achromatisch – aplanatische Kondensor mit Apertur 0,9 (H D Ph DIC). Für die Dokumentation sollte eine Mikroskopkamera gewählt werden, die die fein aufgelösten Strukturen präzise darstellt. Ein einfaches, präzises Bilddokumentationssystem, wie zum Beispiel ZEISS Labscope kann auf einem handelsüblichen Tablet (iPad) oder auch mittels Windows-PC betrieben werden.















Literatur:
[1] https://de.wikipedia.org/wiki/Haar#Tierhaare.2FFell
[2] https://de.wikipedia.org/wiki/Animal_Forensics#Haare
[3] B.J. Teerink; „Hair of Westeuropean Mammals“; Cambridge University Press; ISBN: 0-521-54577-3